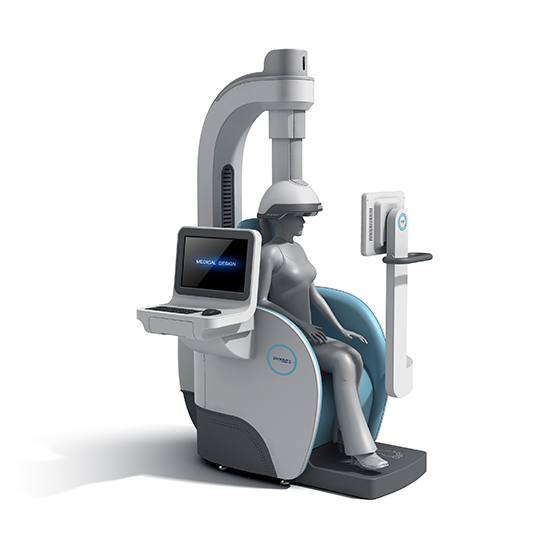
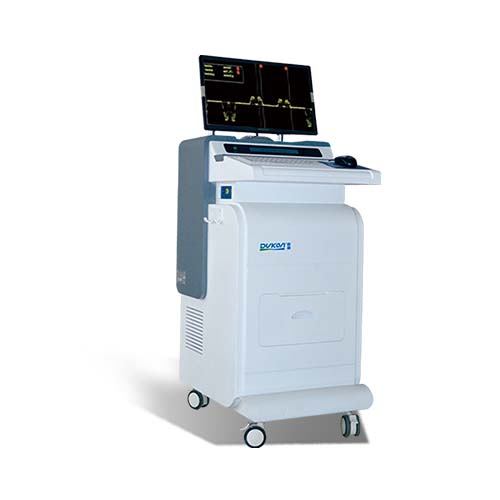
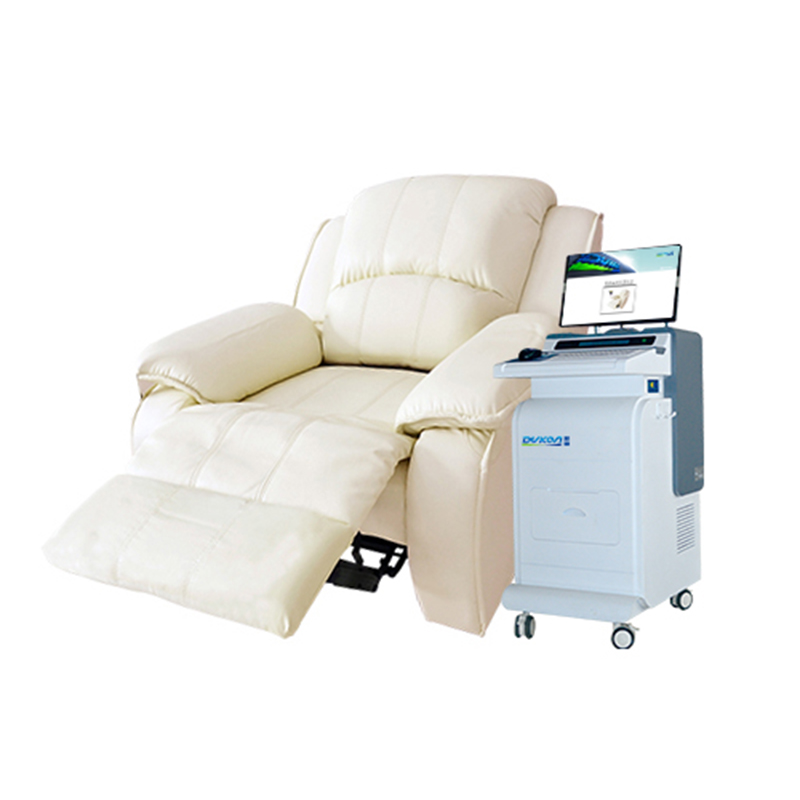
更多>> 最新公告
关注我们
产品分类
联系方式
- 公司名称: 石家庄德人医疗科技有限公司
- 公司地址: 石家庄裕华东路455号
- 电话: 400-862-0778
- E-MAIL: deren@derenkeji.com
- 官方微博: weibo.com/derenkeji
- 销售专线: 400-862-0778
- 售后专线: 400-865-1778
- 郗经理: 18931858131
- 人力资源专线: 0311-68038912
更多>> 关于我们
 石家庄德人医疗科技有限公司位于河北省会石家庄,成立于2005年初,是集科、工、贸一体化专业从事生产和销售康复理疗产品为主的医疗器械公司,在多年的发展中,公司始终遵循“诚信经营 优质服务”的经营理念和“优质高效 开拓创新”的经营方针,通过努力取得了显著的经济效益和社会效益。
石家庄德人医疗科技有限公司位于河北省会石家庄,成立于2005年初,是集科、工、贸一体化专业从事生产和销售康复理疗产品为主的医疗器械公司,在多年的发展中,公司始终遵循“诚信经营 优质服务”的经营理念和“优质高效 开拓创新”的经营方针,通过努力取得了显著的经济效益和社会效益。 公司主营产品为:脑神经康复设备、骨科康复设备、康复中心基础设备,并为医院量身定做康复中心,同时代理经销美州、欧州、日、韩等国多个知名厂家的物理治疗产品。目前,公司产品已覆盖康复运动、康复评定、作业疗法、物理治疗及辅助治疗多个领域,获得业界的广泛认同,客户网络以河北为中心辐射全国,现已成为国内外多个康复设备专业生产厂家的国内总代理或区域代理,已成为全国有名的康复中心设备专业供应国内外多个康复设备专业生产厂家的国内...更多>>>